Corrosie van aluminium
Aluminium beschikt doorgaans over een uitstekende corrosievastheid in zowel natuurlijke milieus, zoet water, zeewater, tal van bodemsoorten en chemicaliën en de meeste voedingswaren. Deze corrosievastheid is te danken aan de aanwezigheid van een passieve oxidefilm op het metaaloppervlak. Toch kan het voorkomen dat deze beschermende oxidefilm wordt doorbroken en er corrosieve aantasting kan optreden.
Passiviteit van aluminium en zijn legeringen
Aard van de oxidefilm
Aluminium is een thermodynamisch actief metaal, alleen beryllium en magnesium zijn actiever. De corrosievastheid wordt ontleend aan de aanwezigheid van een goed hechtende barrièreoxide op het metaaloppervlak. De normale oppervlaktefilm ontstaat in lucht bij omgevingstemperatuur en is slechts zo’n 50 nm (50 Å) dik. Er kunnen veel dikkere lagen worden gevormd bij verhoogde temperaturen, in water bij zijn kookpunt of in stoom. Als de laag wordt beschadigd, bijvoorbeeld in geval van een pas geschuurd metaaloppervlak, hersteld deze laag zich onmiddellijk in de meeste milieus en blijft het metaal beschermen. Als de laag wordt verwijderd onder omstandigheden dat zelfherstel niet kan optreden dan vindt er corrosie plaats. Afbeelding 1 toont schematisch de oxidefilm die ontstaat in normale atmosferen en die bestaat uit twee lagen. De binnenste oxidelaag is een compacte amorfe laag met een dikte die alleen door de temperatuur van het milieu wordt bepaald. Bij elke gegeven temperatuur is de laagdikte hetzelfde in zuurstof, droge lucht of vochtige lucht. Over de barrièrelaag strekt zich een dikkere, meer doordringbare laag uit die bestaat uit gehydrateerd oxide. Het merendeel van de interpretatie van aluminium corrosieprocessen is ontwikkeld in termen van de chemische eigenschappen van deze oxidelagen.
Bij lagere temperaturen is de overheersende vorm die bij corrosie ontstaat bayeriet, Al(OH)3, terwijl dat bij hogere temperaturen boehmiet is, AlO(OH). Tijdens het complexe verloop van het verouderen van aluminiumhydroxide, dat eerst wordt gevormd in een amorfe toestand, kan er ook nog een ander aluminiumtrihydroxide worden gevormd, vooral als er ionen van alkalimetalen aanwezig zijn. Beginnend boven een temperatuur van ongeveer 230°C ontstaat er in water of stoom geen beschermende laag meer en de reactie loopt snel voort totdat uiteindelijk al het aluminium dat aan deze milieus wordt blootgesteld is omgezet in oxide. De natuurlijke film kan worden voorgesteld als het resultaat van een dynamisch evenwicht tussen elkaar tegenwerkende krachten: zij die proberen de compacte barrièrelaag te vormen en zij die deze trachten af te breken. Als de destructieve krachten afwezig zijn, zoals in droge lucht, zal de natuurlijke film alleen bestaat uit de barrièrelaag die snel zijn maximale dikte bereikt. Als de destructieve krachten te sterk zijn, dan zal het oxide sneller worden gehydrateerd dan dat het wordt gevormd en er zal een dunne barrièrelaag achterblijven. Tussen deze uitersten zullen de tegenwerkende krachten een redelijke balans bereiken, waarbij relatief dikke (20 tot 200 nm) natuurlijke films worden gevormd.
Afbeelding 1. Schematische weergave van de passieve oxidefilm die op het aluminiumoppervlak ontstaat.
De voorwaarden voor thermodynamische stabiliteit van de oxidefilm worden weergegeven door het Pourbaix (potentiaal versus pH) diagram zoals is te zien op afbeelding 2. Zoals is te zien op dit diagram is aluminium passief (wordt beschermd door zijn oxidefilm) in het pH gebied lopend van ongeveer 4 tot 8,5. De grenzen van dit gebied variëren enigszins met de specifieke vorm van de aanwezige oxidefilm en met de aanwezigheid van stoffen die oplosbare complexen of onoplosbare zouten kunnen vormen met aluminium. De relatieve inertheid in het passieve gebied wordt verder geïllustreerd aan de hand van afbeelding 3, die de resultaten weergeeft van gewichtsafname metingen voor legering 3004-H14 proefstukken die zijn geëxposeerd in water en in zoutoplossingen bij verscheidene pH waarden. Buiten de grenzen van het passieve gebied corrodeert aluminium in waterige oplossingen omdat zijn oxiden oplosbaar zijn in tal van zuren en basen, waarbij Al3+ ionenin zuren en AlO2- (aluminaat) ionen in basen. Er zijn echter instanties waar er geen corrosie optreedt buiten het passieve gebied, bijvoorbeeld als de oxidefilm onoplosbaar is of als de film wordt gehandhaafd door de oxiderende aard van de oplossing. 
Afbeelding 2. Pourbaix diagram van aluminium met daarop aangegeven de voorwaarden corrosie, immuniteit en passivering van aluminium bij 25°C, onder aanname dat de beschermende laag bestaat uit Al2O3.3H2O.
Oorzaken en vormen van corrosie
In de meeste milieus gaat de corrosie van aluminium gepaard met het vloeien van elektrische stroom tussen anodische en kathodische gebieden. De optredende elektrochemische corrosie hangt af van de potentialen van deze gebieden.
Oplospotentiaal
Wegens de elektrochemische aard van de meeste corrosieprocessen, zijn de betrekkingen tussen oplospotentialen van verschillende aluminiumlegeringen onderling, als tussen de potentialen van aluminiumlegeringen en die van andere metalen van groot belang. Voorts zijn de oplospotentiaal (of corrosiepotentiaal) betrekkingen tussen microstructuurbestanddelen van een bepaalde legering van grote invloed op het corrosiegedrag. Samenstelling van vaste oplossingen en bijkomende fazen, alsmede hoeveelheid en verdeling van deze fazen, kunnen van invloed zijn op zowel type als mate van corrosie. De oplospotentiaal (Ecorr) van een aluminiumlegering wordt primair bepaald door de samenstelling van de aluminiumrijke vaste oplossing, die de dominerende volumefractie en oppervlaktefractie uitmaakt van de microstructuur van de legering. De oplospotentiaal wordt niet significant beïnvloed door tweedefaze deeltjes met microscopische afmetingen. Omdat deze deeltjes vaak een oplospotentiaal hebben die verschilt van die van de vaste matrix waarin ze voorkomen, kunnen er lokale galvanische cellen ontstaan tussen tweedefaze deeltjes en de matrix. De effecten van hoofdlegeringselementen op de oplospotentiaal van hoogzuiver aluminium zijn te zien op afbeelding 4. 
Afbeelding 3. Gewichtsafname van legering 3004-H14, geëxposeerd gedurende 1 week in gedistilleerd water en in oplossingen met verschillende pH waarden. Proefstukgrootte: 1,6 x 13 x 75 mm. De pH van de oplossingen werd geregeld met HCl en NaOH. Proeftemperatuur: 60°C.
Afbelding 4. Invloed van hoofdlegeringselementen op elektrolytische oplospotentiaal van aluminium. Potentialen zijn van hoogzuivere binaire legeringen oplosgegloeid en afgeschrikt. Metingen zijn uitgevoerd in een oplossingen van 53 g/l NaCl plus 3 g/l H2O2 bij 25°C.
Voor elk element treden de veranderingen op binnen het gebied waarin het element volledig is opgelost in de matrix. Verdere toevoeging van hetzelfde element, dat een tweedefaze vormt, doet de oplospotentiaal maar weinig veranderen. De meeste commerciële aluminiumlegeringen bevatten toevoegingen van meer dan een van de hoofdlegeringselementen. Effecten van meervoudige elementen in vaste oplossing op de oplospotentiaal zijn bij benadering additief. De hoeveelheden die in vaste oplossing blijven, in het bijzonder bij de wat hoger gelegeerde samenstellingen, hangen sterk af van fabricage en thermische behandeling, zodat warmtebehandeling en andere verwerkingsvariabelen de uiteindelijke oplospotentiaal van het product beïnvloeden. Meting van oplospotentialen is bruikbaar voor het onderzoek van warmtebehandelings-, afschrik- en verouderingspraktijken en wordt hoofdzakelijk gebruikt bij legeringen die koper, magnesium of zink bevatten. In aluminium-koper-magnesium (2xxx) legeringen kunnen met potentiaalmetingen de effectiviteit worden bepaald van oplosgloeibehandeling door de hoeveelheid koper in vaste oplossing te meten. Ook kan met het afzonderlijk meten van de potentialen van korrelgrenzen en korrels, het potentiaalverschil worden bepaald dat verantwoordelijk is voor interkristallijne corrosie, exfoliatie en scheurvormende spanningscorrosie (SSC).
Oplossing-potentiaalmetingen van legeringen die koper bevatten tonen de voortgang aan van kunstmatige veroudering als er steeds grotere hoeveelheden precipitaten worden gevormd en er koperverarming in de matrix optreedt. Potentiaalmetingen zijn waardevol met zinkhoudende (7xxx) legeringen voor het bepalen van de effectiviteit van oplosgloeibehandelingen, voor het volgen van het verouderingsproces en voor het uit elkaar houden van de verschillende kunstmatige-verouderingstoestanden. Deze factoren kunnen van invloed zijn op het corrosiegedrag. Bij de magnesiumhoudende (5xxx) legeringen kunnen potentiaalmetingen lage-temperatuur precipitatie worden gedetecteerd en ze zijn bruikbaar voor het kwalitatief evalueren van spanningscorrosie gedrag. Potentiaalmetingen kunnen ook worden gebruikt voor het volgen van diffusie van zink of koper in alclad producten, waarmee kan worden bepaald of de opofferingslaag het onderliggende metaal nog wel beschermd.
Putcorrosie
Corrosie van aluminium in het passieve gebied is lokaal en doet zich doorgaans voor in de vorm van willekeurig verspreide putten. Hierbij geldt dat de potentiaal (Ep) waarbij putcorrosie kan optreden in een bepaalde oplossing, die potentiaal is waaronder geen en daarboven wel putten kunnen ontstaan. Er zijn vier laboratoriumprocedures ontwikkeld om Ep te meten. Een is gebaseerd op vaste stroom en de andere drie zijn gebaseerd op gecontroleerde potentiaal. De meest gebruikte is de gecontroleerde potentiaal, waarbij de potentiaal van een proefstuk, gewoonlijk ondergedompeld in een bepaalde onbeluchte oplossing, stapsgewijs positiever wordt gemaakt. De resulterende stroomdichtheid van het proefstuk wordt gemeten. De potentiaal waarbij de stroomdichtheid scherp toeneemt en hoog blijft wordt de doorbraakpotentiaal genoemd (Ebr). In geval van gepolijste proefstukken valt Ebr nagenoeg samen met Ep en wordt er geen onderscheid gemaakt tussen deze beide potentialen.
Afbeelding 5 geeft een voorbeeld. Een proefstuk gemaakt van legering 1100 is ondergedompeld in een neutrale, ontluchte natriumchloride (NaCl) oplossing en de relatie tussen anodepotentiaal en stroomdichtheid is getekend (getrokken lijn). Bij potentialen die actiever zijn dan Ep, waar de oxidelaag behouden blijft, is anodische polarisatie makkelijk en corrosie verloopt traag en uniform. Boven Ep is polarisatie moeilijk en de stroomdichtheid neemt scherp toe. Het oxide wordt op willekeurige zwakke plekken doorbroken en is niet in staat zichzelf te herstellen en op deze plaatsen ontwikkelt zich lokale corrosie. Potentiaal-stroom relaties voor verscheidene kathodische reacties zijn op afbeelding 5 aangegeven met streeplijnen. Alleen als de kathodische reactie voldoende is om het metaal te polariseren tot aan zijn putpotentiaal zal er significante stroomdoorgang en putcorrosie van start gaan.
Afbeelding 5. Anodische polarisatiecurve voor aluminiumlegering 1100.
Proefstukken zijn ondergedompeld in een neutrale, ontluchte NaCl oplossing die vrij is van kathodische reactanten. Er ontwikkelen zich alleen putten bij potentialen die kathodischer zijn dan de putpotentiaal Ep. Doorsnijding van de anodische curve voor aluminium (getrokken lijn) met een curve voor de toepasbare kathodische reactie (een van de streeplijnen) bepaalt de potentiaal tot waarbij aluminium is gepolariseerd, hetzij door kathodische reactie aan het aluminium zelf of aan een ander metaal dat er elektrisch geleidend mee is gekoppeld. De potentiaal waarop het aluminium is gepolariseerd door een specifieke kathodereactie bepaalt de corrosie-stroomdichtheid en de corrosiesnelheid. Bij aluminium wordt putcorrosie het meest veroorzaakt door halide ionen, waarvan chloride (Cl-) het meest voorkomt in de praktijk. De invloed van de chloride-ionconcentratie op de putpotentiaal van aluminium 1199 (99,99+% Al) is te zien op afbeelding 6. Putcorrosie van aluminium in halide-oplossingen die in open verbinding staan met lucht treedt op, omdat in de aanwezigheid van zuurstof het metaal makkelijk wordt gepolariseerd tot aan zijn putpotentiaal. In afwezigheid van opgeloste zuurstof of enig ander kathodisch reactant, zal aluminium geen putcorrosie vertonen omdat het niet wordt gepolariseerd tot zijn putpotentiaal. In het algemeen ontwikkelt aluminium geen putcorrosie in beluchte oplossingen van de meeste halidezouten omdat de putpotentiaal in deze oplossingen aanzienlijk kathodischer is dan in halide-oplossingen en er tijdens normaal bedrijf geen polarisatie tot aan de putpotentiaal optreedt. 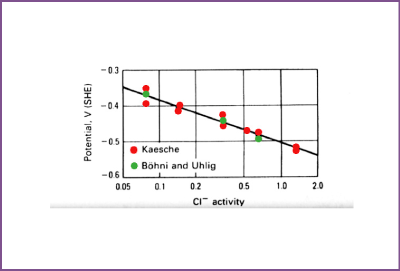
Afbeelding 6. Effect van chloride-ionactiviteit op putpotentiaal van aluminium 1199 in NaCl oplossingen.



