Blog Ko Buijs - Het potentiaalverschil
In de metaalkunde wordt het begrip ‘potentiaal’ gedefinieerd als de elektrische spanning, die een metaal aanneemt wanneer het in een geleidende vloeistof wordt gedompeld. Deze spanning wordt uitgedrukt in Volt. Deze spanning wordt veroorzaakt door de hoeveelheid metaalionen die in oplossing gaan in een vloeistof en de daarmee equivalente hoeveelheid elektronen die per oppervlakte-eenheid in het metaal aanwezig zijn.
Door Ko Buijs - Innomet Consultancy BV
De grootte van de spanning wordt bepaald door de edelheid van een metaal, ofwel hoeveel metaalionen er in oplossing gaan in een elektrolyt. Ook water is in de corrosieleer een elektrolyt omdat het stroom geleid. Des te meer ionen in oplossing gaan, des te onedeler het metaal is. Bij platina (Pt) en goud (Au) gaan er geen ionen in oplossing, bij halfedele metalen zoals koper (Cu) en nikkel (Ni) relatief weinig en bij onedele metalen, zoals bij zink (Zn) en magnesium (Mg), gaan er veel tot zeer veel metaalionen in oplossing. Zo ontstaat er een edelheidsreeks die grafisch uitgezet kan worden zoals in onderstaande afbeelding is te zien.Het element ijzer (Fe) heeft vanwege zijn actieve karakter een negatieve potentiaal en bij voldoende aanwezigheid van circa 12% chroom (Cr) verschuift deze potentie naar het passieve gebied. Zo ontstaat roestvast staal omdat het zich nu edel gedraagt dankzij een chroomoxidehuid. Dit is zichtbaar gemaakt d.m.v. de rode pijlen in onderstaande grafiek.
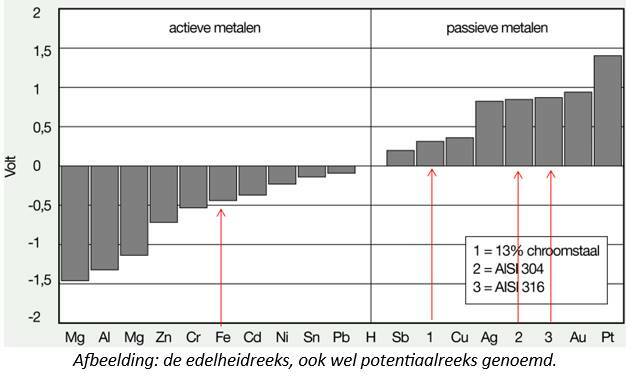
Afbeelding: de edelheidreeks, ook wel potentiaalreeks genoemd.
Plaatst men twee met elkaar verbonden metalen met een hoge en een lage potentiaal in een geleidende vloeistof, dan zal laatstgenoemd metaal zich offeren ten gunste van het andere. Deze corrosie wordt galvanische corrosie genoemd. Feitelijk kan dit mechanisme ook aangeduid worden met de term kathodische bescherming. Eigenlijk is dat een gewenste vorm van galvanische corrosie. Een bekend voorbeeld zijn de zinkanodes op de scheepswand van een schip die de stalen scheepshuid moeten beschermen tegen corrosie. De elektromotorische kracht van het corrosie-element is het verschil van de potentialen tussen twee verschillende metalen. Het is echter niet mogelijk het potentiaalverschil tussen de elektrode en de vloeistof te meten en daarom is er een referentie-elektrode in het leven geroepen. In de praktijk werkt men dan ook veelal met de waterstofelektrode die per definitie de potentiaal 0 Volt heeft gekregen. Men kan zo altijd het potentiaalverschil meten zowel van de anode als de kathode t.o.v. deze neutrale waterstofelektrode. De vraag kan dan gesteld worden of roestvast staal een hoge elektrodepotentiaal bezit. Roestvast staal heeft inderdaad een hoge elektrodepotentiaal vergeleken met de meeste andere metalen. Deze hoge potentiaal heeft echter alleen betrekking op de passieve oxidehuid die het roestvast staal beschermd tegen corrosie. Dankzij dit feit zijn er maar weinig metalen die in combinatie met roestvast staal galvanische corrosie van het laatstgenoemde metaal kan veroorzaken. Er kan echter wel galvanische corrosie tussen twee roestvaste staalsoorten optreden als er tussen die twee een groot potentiaalverschil aanwezig is. Een goed voorbeeld hiervan is de combinatie tussen chroomstaal en het hoogwaardige 904L (1.4539).
Een ander bekend praktijkvoorbeeld van galvanische corrosie is een gelaste verbinding waarvan de las minder legeringselementen bevat, waardoor de las relatief snel wordt aangetast. Dit is vooral het geval indien reactieve legeringselementen zoals chroom tijdens het lassen gedeeltelijk verbranden. Ook de combinatie roestvast staal en grafiet kan leiden tot aanzienlijke corrosieschade en daarom moeten grafiet pakkingen altijd worden vermeden. De hoge elektrodepotentiaal van roestvast staal bewerkt in combinatie met minder edele metalen een aanzienlijke corrosieversnelling van de laatstgenoemde metalen. Uiteraard moeten deze dan wel in een elektrolyt worden geplaatst. Daarentegen zullen koper en koperlegeringen een zeer geringe lagere potentiaal bezitten ten opzichte van austenitisch roestvast staal waardoor er nauwelijks galvanische corrosie tussen die twee metalen zalontstaan, alhoewel dit nooit helemaal uitgevlakt mag worden. Ook wordt in de corrosieleer het begrip pittingpotentiaal gebruikt. De pittingpotentiaal is de elektrochemische potentiaal waarbij roestvast staal in een bepaald milieu putcorrosie gaat vertonen. Het is mogelijk om de weerstand tegen put- en spleetcorrosie te bepalen door een elektrochemische testmethode. Dit wordt gedaan door een externe stroombron aan te sluiten op een monster metaal wat ondergedompeld is in een chloridehoudend medium. Zo zal het potentiaalverschil toenemen waardoor het medium de passieve huid binnen kan dringen. De potentiaal waarop dit gebeurt, noemt men het pittingpotentiaal en het is een maat van de weerstand wanneer putcorrosie een aanvang neemt. Een hoog pittingpotentiaal wil zeggen dat het roestvast staal een hoge weerstand geniet tegen het begin van putcorrosievorming.




